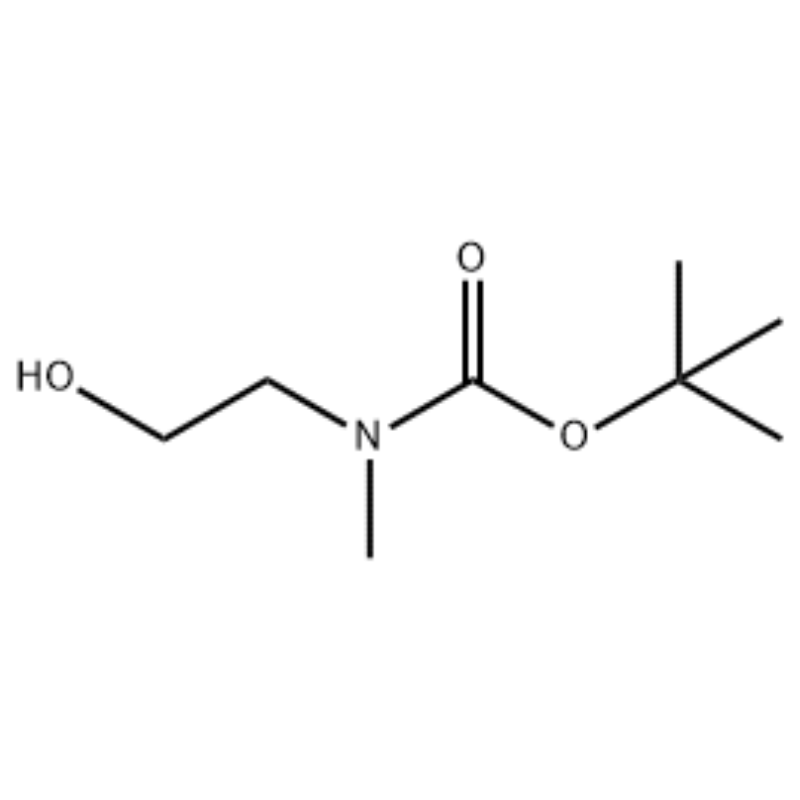
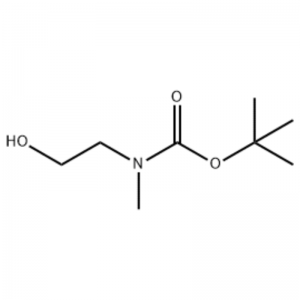
A unha solución de 2-(metilamino)etanol (500 mg, 0,53 ml, 6,66 mmol) en CH2Cl2 (20 ml) engadiuse Boc2O (1,48 g, 6,79 mmol), seguido de axitación a temperatura ambiente durante 1 hora.A solución de reacción extraeuse con salmoira e CH2Cl2.A capa orgánica así obtida secouse sobre MgSO4 e filtróuse.Despois, o filtrado concentrouse ao baleiro para obter o composto obxecto (aceite incoloro, cuantitativo);RMN 1H (200 MHz, CDCl3) delta 3,74 (q, J= 10,5, 5,2 Hz, 2H) 3,25 (t, J= 5,2 Hz, 2H) 2,91 (s, 3H) 1,45 (s, 9H);espectro de masas m/e (intensidade relativa) 144 (20) 102 (24) 57 (70) 44 (100).
Exemplo 38;N1-(3-fluoro-4-(2-(1-(2-(metilamino)etil)-1H-imidazol-4-il)tieno[3,2-b]piridin-7-iloxi)fenil)-N3 -(2-metoxifenil)malonamida (96);Paso 1: 2-hidroxietil(metil)carbamato de terc-butilo (97) (J. Med. Chem., 1999, 42, 11, 2008) A unha solución de 2-(metilamino)etanol (5,0 g, 67 mmol) en Engadiuse THF (50 ml) a TA Boc2O (15,7 g, 72 mmol) e a mestura de reacción axiuse a TA durante 4 horas.A mestura de reacción concentrouse ata sequedade e o composto do título 97 utilizouse directamente no seguinte paso sen purificación adicional (11,74 g, 100 % de rendemento).MS (m/z): 176,2 (M+H).
Preparación de l-2-[4-Bromo-2-(4-oxo-2-ftiotaioxo1hiazolidin-5-ilidenmefliil)fenoxi]efliil-3-efliil-l-metilurea (Compoiotamd 161) Paso 1: Síntese de t-butyl2- hidroxietilmetilcarbamato;A unha solución de 2-(metilamino)etanol (500 mg, 0,53 ml, 6,66 mmol) en CH2Cl2 (20 ml) engadiuse BoC2O (1,48 g, 6,79 mmol), seguido de axitación a temperatura ambiente durante 1 hora.A solución de reacción extraeuse con salmoira e CH2Cl2.A capa orgánica así obtida secouse sobre MgSO4 e filtróuse.Despois, o filtrado concentrouse ao baleiro para obter o composto obxecto (aceite incoloro, cuantitativo); 2H) 2,91 (s, 3H) 1,45 (s, 9H);espectro de masas m/e (intensidade relativa) 144 (20) 102 (24) 57 (70) 44 (100).
Disolveuse 2-(metilamino)etanol (90,1 g, 1,2 mol) en 1,2 L de cloruro de metileno, e engadíuselle lentamente BoC2O (218 g, 1 mol) mentres se axitaba a 0 ºC, seguido de a temperatura ambiente durante 3 horas.A mestura de reacción foi lavada secuencialmente con 700 ml dunha solución acuosa de cloruro de amonio saturado e 300 ml de auga.A mestura lavada deshidratouse usando sulfato sódico anhidro e concentrouse a presión reducida, para obter o composto (a) (175 g, 1 mol, 100%) como un aceite sen cor. TLC: Rf = 0,5 (50% EtOAc en Hex) visualizado con tinción Ce-Mo 1H RMN (600MHz, CDCl3) delta 1,47 (s, 9H), 2,88 (br s, IH), 3,41 (br s, 2H), 3,76 (br s, 2H).
Disolvéronse 90,1 g (1,2 mol) de 2-(metilamino)etanol en 1,2 L de cloruro de metileno, engadíronselle lentamente 218 g (1 mol) de Boc2O mentres a solución resultante se axitaba a 0 °C e a solución resultante axitábase a 0ºC. temperatura ambiente durante 3 horas.A mestura de reacción foi lavada secuencialmente con 700 mL dunha solución acuosa saturada de cloruro de amonio e 300 mL de auga, deshidratada con sulfato sódico anhidro e despois concentrada a presión reducida para obter 175 g (1 mol) dun composto de aceite acrómico protexido polo Grupo Boc (rendemento: 100%).RMN 1H (600MHz, CDCl3) delta 7,84 (br s, 2H), 7,76 (br s, 2H), 4,34 (d, J = 15,0 Hz, 2H), 3,63 (br s, 2H), 3,04 (d) , J = 15,0 Hz, 3H), 1,46 (d, J = 16,2 Hz, 9H) [0141] 90 g (0,514 mol) do composto obtido foron disoltos en 1,5 L de tetrahidrofurano, 88,0 g (539 mol) de N- Engadíronselle hidroxiftalimida e 141 g (0,539 mol) de trifenilfosfina, engadíronselle lentamente 106 ml (0,539 mol) de azodicarboxilato de diisopropilo mentres se axitaba a solución resultante a 0 °C, e a solución resultante axitáballe durante 3 horas mentres se elevaba a súa temperatura. a temperatura ambiente.Despois de concentrar a mestura de reacción a presión reducida, engadíronselle 600 ml de isopropiléter, a solución resultante axitouse a 0ºC durante 1 hora e filtróuse o óxido de trifenilfosfina de tipo sólido branco.O sólido lavouse con 200 ml de isopropiléter arrefriado a 0ºC e recolleuse co primeiro filtrado, e o filtrado resultante concentrouse a presión reducida para obter 198 g dunha mestura de composto XX e hidrazodicarboxilato de diisopropilo nunha proporción de mestura do 10 ao 15 %. (rendemento: 120%).RMN 1H (600MHz, CDCl3) delta 7,84 (br s, 2H), 7,76 (br s, 2H), 4,34 (d, J = 15,0 Hz, 2H), 3,63 (br s, 2H), 3,04 (d) , J = 15,0 Hz, 3H), 1,46 (d, J = 16,2 Hz, 9H)
 Edificio 12, No.309, South 2nd Road, Zona de Desenvolvemento Económico, Distrito Longquanyi, Chengdu, Sichuan, China.
Edificio 12, No.309, South 2nd Road, Zona de Desenvolvemento Económico, Distrito Longquanyi, Chengdu, Sichuan, China. amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com
amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com +86 (028) 84841969
+86 (028) 84841969 +86 135 5885 5404
+86 135 5885 5404



















.png)


