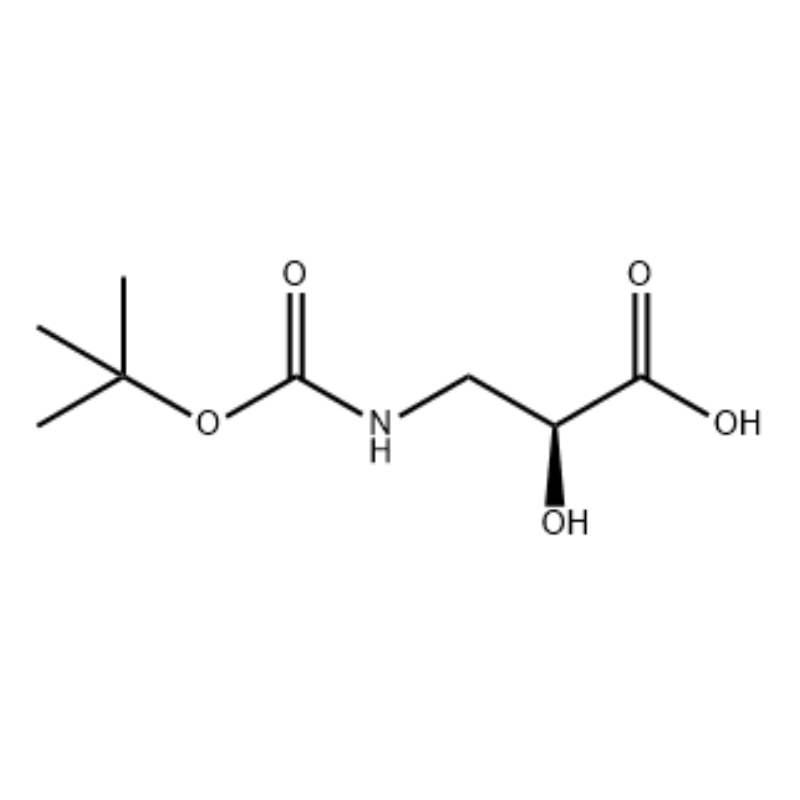
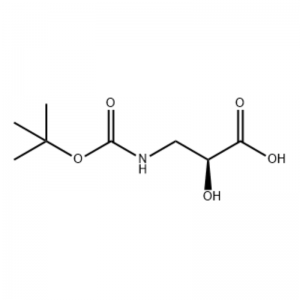
(S)-isoserina 15a (21 g, 0,20 mol) foi disolta en tetrahidrofurano (100 ml) e un disolvente mixto de solución acuosa de hidróxido de sodio ao 10 por cento (100 ml), dicarbonato de di-terc-butil (50 ml, 0,22 mol) engadido gota a gota. A reacción realizouse a temperatura ambiente durante 9 horas. A fase acuosa axustouse a pH 2 con ácido clorhídrico 4 mol/L e extraeuse con diclorometano/metanol (v/v = 5/1, 50 mL × 3). ) e secou sobre sulfato de sodio anhidro.Filtrar por succión, concentrar a presión reducida,O composto do título 15b obtívose como un aceite incoloro (35 g, rendemento: 85 por cento).
A unha solución con axitación de S-isoserina (4,0 g, 0,038 mol) en dioxano: H2O (100 ml, 1:1 v/v) a 0 °C engadiuse N-metilmorfolina (4,77 ml, 0,043 mol), seguido de BoC2O (11,28 ml, 0,049 mol) e a reacción foi axitada durante a noite co quecemento gradual a temperatura ambiente.A continuación, engadiuse glicina (1,0 g, 0,013 mol) e a reacción axiuse durante 20 min.A reacción arrefriouse a 0 ºC e sat.Engadiuse NaHCO3 (75 ml).A capa acuosa foi lavada con acetato de etilo (2 x 60 ml) e despois acidificouse a pH 1 con NaHSO4.A continuación, esta solución extraeuse con acetato de etilo (3 x 70 ml) e estas capas orgánicas combinadas secáronse sobre Na2SO4, filtráronse e concentráronse ata sequedade para dar o ácido N-Boc-3-ammo-2(S)-hidroxi-propanoico desexado. (6,30 g, 0,031 mmol, 81,5 por cento de rendemento): 1H RMN (400 MHz, CDC13) δ 7,45 (bs, 1 H), 5,28 (bs, 1 H), 4,26 (m, 1 H), 3,40-3,62 (m) , 2 H), 2,09 (s, 1 H), 1,42 (s, 9 H);13C RMN (IOO MHz, CDC13) δ 174,72, 158,17, 82, 71,85, 44,28, 28,45.
ácido N-Boc-3-amino-2(S)-hidroxi-propiónico;A unha solución con axitación de S-isoserina (4,0 g, 0,038 mol) en dioxano: H2O (100 ml, 1:1 v/v) a 0 °C engadiuse N-metilmorfolina (4,77 ml, 0,043 mol), seguido de BoC2O (11,28 ml, 0,049 mol) e a reacción foi axitada durante a noite co quecemento gradual a temperatura ambiente.A continuación, engadiuse glicina (1,0 g, 0,013 mol) e a reacción axiuse durante 20 min.A reacción arrefriouse a 0 °C e sat.Engadiuse NaHCO3 (75 ml).A capa acuosa foi lavada con acetato de etilo (2 x 60 ml) e despois acidificouse a pH 1 con NaHSO4.A continuación, esta solución extraeuse con acetato de etilo (3 x 70 ml) e estas capas orgánicas combinadas secáronse sobre Na2SO4, filtáronse e concentráronse ata sequedade para dar o ácido N-Boc-3-amino-2(5)-hidroxi-propanoico desexado. (6,30 g, 0,031 mmol, 81,5 por cento de rendemento): 1H RMN (400 MHz, CDC13) δ 7,45 (bs, 1 H), 5,28 (bs, 1 H), 4,26 (m, 1 H), 3,40-3,62 (m) , 2 H), 2,09 (s, 1 H), 1,42 (s, 9 H);13C RMN (100 MHz, CDC13) δ 174,72, 158,17, 82, 71,85, 44,28, 28,45.
 Edificio 12, No.309, South 2nd Road, Zona de Desenvolvemento Económico, Distrito Longquanyi, Chengdu, Sichuan, China.
Edificio 12, No.309, South 2nd Road, Zona de Desenvolvemento Económico, Distrito Longquanyi, Chengdu, Sichuan, China. amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com
amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com +86 (028) 84841969
+86 (028) 84841969 +86 135 5885 5404
+86 135 5885 5404











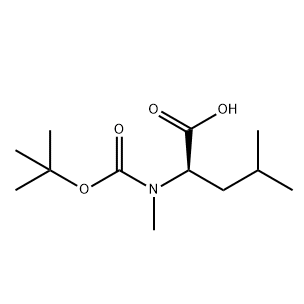






.png)


